Как убрать след от утюга на одежде (темной и светлой)
Каждая хозяйка хотя бы один раз сталкивается с такой неприятностью как оставленный след от утюга на одежде. Причин тому может быть несколько:
- выбранный температурный режим не подходит для данного вида ткани;
- утюг находится на ткани долгое время без движения;
- на подошве утюга имеются подпалины.
Если эта неприятность все же случилась, не стоит расстраиваться. А лучше, как можно скорее постарайтесь ликвидировать неприятность. В большинстве случаев это будет довольно легко сделать, если конечно ткань не обуглилась или хуже того, на ней уже появились дыры.
Читайте в этой статье:
- Что делать, если повреждена светлая ткань
- Что делать, если повреждена темная ткань
- Как правильно гладить одежду, чтобы не повредить ее утюгом
Что делать, если повреждена светлая ткань
На светлой ткани утюг оставляет след в виде светло – желтого пятна, которое может выглядеть ужасно, но приложив некоторые усилия можно вернуть вещи ее первозданный вид.
Рецепты:
- На желтое пятно нужно нанести порошок борной кислоты и через некоторое время оно должно исчезнуть. После этого вещь нужно постирать как обычно.
- Нужно приготовить хлорный раствор. Для этого берем чайную ложку хлорной извести и 200 мл воды. Полученным раствором смочите всю площадь пятна и оставьте на пару часов. Затем вещь постирайте в теплой воде, что бы устранить неприятный запах.
Этот рецепт подходит только для чисто белых вещей, поскольку полученный раствор довольно агрессивен и способен обесцветить краски ткани.
- Солевой раствор также может помочь удалить пятно от утюга на ткани. Для этого в стакан воды добавьте ложку соли, размешайте и нанесите на пятно, полностью смочив его. Затем сверху присыпьте обычной солью и оставьте в таком виде до высыхания.
- В следующий рецепт также входит соль, а еще лимонный сок и солнце. Нужно смочить место загрязнения лимонным соком и сверху посыпать мелкой солью.
 Вещь, с нанесенной на нее смесью, оставляется на солнце до полного высыхания.
Вещь, с нанесенной на нее смесью, оставляется на солнце до полного высыхания. - Для прочных тканей, например льна, хорошо подойдет смесь нашатыря и перекиси водорода, взятых в одинаковой пропорции. Нужно этой смесью смочить пятно и оставить на несколько минут, примерно 10-15. После этого пятно обработать хозяйственным мылом и постирать.
Что делать, если повреждена темная ткань
На темной ткани повреждения от утюга выглядят как некрасивое блестящее пятно. Избавиться от него, к сожалению, несколько сложнее, чем от подпалины на белом полотне.
И еще, при использовании народных средств нужно помнить, что многие вещества могут вести себя агрессивно и обесцветить ткань.
Рецепты:
- Если пятно только что появилось, то как экстренную помощь можно использовать хозяйственное мыло. В мыльном растворе нужно смочить марлю или тонкую ткань, затем приложить ее к поврежденному месту и прогладить утюгом несколько раз.
- Если блестящее пятно появилось некоторое время назад, то можно попытаться воспользоваться уксусом.
 Протрите место повреждения ватным тампоном, смоченным в уксусе, а затем прогладьте через влажную марлю.
Протрите место повреждения ватным тампоном, смоченным в уксусе, а затем прогладьте через влажную марлю. - Следующий метод – это использовать кисломолочные продукты. Для этого нужно взять простоквашу или кефир и нанести на пятно. Вещь оставляется в таком виде примерно один час. Затем ее тщательно ополаскивают и стирают как обычно.
- Еще помощь может оказать обычная луковица. Нужно протереть ее на терке или блендере в мелкую кашицу и нанести на поврежденное место.
Можно просто протереть повреждение кусочком луковицы.
Как правильно гладить одежду, чтобы не повредить ее утюгом
Как всем известно, проблему лучше предотвратить, чем потом бороться с ней.
Поэтому при глажке вещей нужно соблюдать несколько несложных правил, которые помогут не испортить любимую юбку или кофточку.
- Всегда сохраняйте этикетки от одежды, поскольку именно сюда производитель наносит основные сведения о составе ткани и уходе. Если ярлыки на одежде вас раздражают, то можно срезать их и хранить в отдельной коробочке, сделав пометку шариковой ручкой на каждой бирке, какой вещи она принадлежит.

- Перед тем как начать процесс глажки посмотрите, есть ли на подошве утюга, какие либо загрязнения. Если есть, то нужно произвести очистку. На старых утюгах с этой проблемой отлично справлялась соль. Для современных, с тефлоновым покрытием лучше использовать мягкую ткань.
- Такие вещи как черные шерстяные брюки или юбка лучше гладить с изнаночной стороны, это гарантированной избавит вещи от нежелательного блеска.
- Если погладить с изнаночной стороны будет проблематично, например пиджак, то нужно использовать тонкую ткань, либо марлю, смоченную в воде. В некоторых утюгах предусмотрена функция постоянной подачи пара, она также поможет в данном случае.
Используя эту функцию, всегда ставьте утюг на доску подошвой от себя. Выпущенное облачко пара очень горячее и может сильно обжечься.
Итак, повредив вещь утюгом не нужно расстраиваться и выкидывать ее. Если не помогает один рецепт, то, скорее всего, может помочь другой. Главное начать процедуру очищения как можно раньше и не расстраиваться после первой неудачи.
Как замаскировать пятно от утюга с помощью подручных средств
У большинства людей, что пользуются бытовыми приборами, возникали хотя бы раз неблагоприятные последствия от взаимодействия с техникой. Однако в этом нет ничего страшного, так как проблему чаще всего можно устранить самостоятельно. Так, в написанной статье рассмотрим варианты исключения блеска и пятен на одежде после использования утюга.
Как убрать блеск от утюга
Предварительно стоит понимать, что причины этому могут быть разными. Например, пользователь не ухаживает за устройством, нарушает правила тепловой обработки, не устанавливает рекомендуемый режим температуры. В любом случае следует попробовать устранить лоск. Так, существует несколько способов, к которым по желанию можно придерживаться.
На синтетике
Первый метод наиболее распространенный и простой.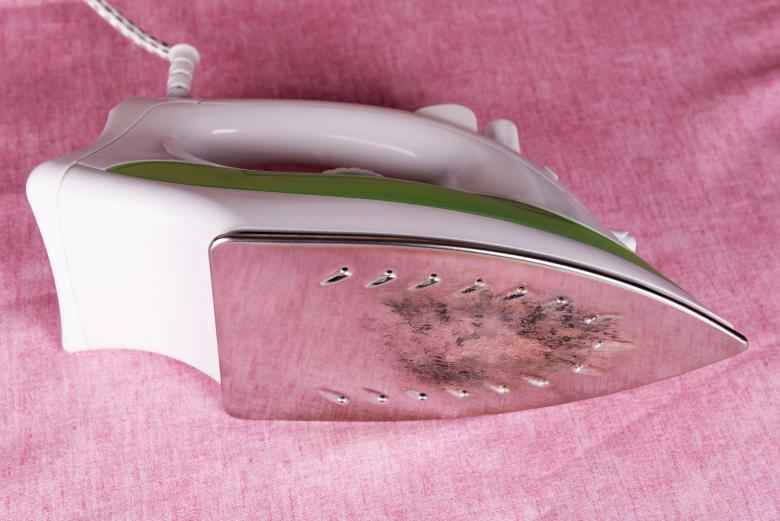 Он заключается в использовании уксуса и представляет собой следующий алгоритм действий:
Он заключается в использовании уксуса и представляет собой следующий алгоритм действий:
- Сначала смешивается 1 чайная ложка уксуса 9% с 1 литром воды.
- В таком растворе смачивается марля и кладется на необходимое место.
- После можно приступать к отпариванию до тех пор, пока не появится результат.
Кроме этого, в процессе можно применять черный чай. При этом нужно всего лишь смочить ватное изделие в заварке, качественно отжать его и приложить на блеск. Держать надо оборудование также до его исчезновения.
Внимание! К последнему исходу события можно придерживаться только в том случае, если одежда темного цвета. Так как на белом остаются пятна от заварки.
На шелковой и шифоновой ткани
К шелку стоит обращаться несколько иначе. Итак, понадобится выполнение ниже указанных пунктов:
- 1 ч. ложка соды смешивается с водой в чашке.

- Следовательно, в получившемся растворе смачивается материал и отпаривается.
Можно встретить аналогичный процесс. Хотя зачастую он является менее эффективным, но все же:
- Из небольшого количества холодной воды и соды создается некая масса, которую в дальнейшем надо распределить на материю.
- Так, следует выждать время до полного высыхания.
- В завершение удалить ингредиенты. На всякий случай можно простирать.
Как убрать пятно от утюга
Пятна также реально ликвидировать с тканевого материала. И при этом можно выделить множество способов. Ниже представлены некоторые из них.
Отбеливателем
После стирки потребно воспользоваться специальным средством. Нельзя допускать его взаимодействие с шелком и шерстью, так как последние из них скорее испортятся. Для достижения надо реализовать этапы:
-
Предварительно лучше подготовить вещь. Для этого можно прополоскать ее.
Для этого можно прополоскать ее. - Далее создаем смесь из моющего средства, жидкости и порошка. Так, ее важно втереть в ткань и оставить для впитывания на несколько минут.
- Как только раствор начнет действовать, потребно выстирать вещь в стиральной машинке и просушить так, как вам угодно.
Перекисью водорода
Для этого метода потребуются только перекись и нашатырный спирт.
- Сначала надобно смочить посторонний кусок материала вышеуказанными жидкостями.
- Положив источник проблемы на гладильную доску, этим куском надо накрыть испорченную зону. А поверх всего положить сухое изделие.
- Такую конструкцию стоит прогладить, при этом придерживаясь к минимальному показателю градуса. Именно так состав будет проникать в волокна и постепенно выводить нежелательное образование с поверхности.
Лимонный сок
Если вы имеете возможность воспользоваться лимоном, то сначала из него придется выдавить весь сок непосредственно на нужное место. Затем требуется смочить предмет гардероба в воде.
Затем требуется смочить предмет гардероба в воде.
Справка! Следует таким образом его держать от 15 минут до получаса. После замачивания надобно качественно отжать вещь и прополоскать.
В завершение остается всего лишь высушить. Кроме данного вида цитруса обычно используется кашица из зеленного лука, а также уксус (но не яблочный и винный).
Конечно, возможно отыскать массу вариантов по данной теме. Но это в очередной раз свидетельствует о том, что практически каждое пятно, лоск можно своими усилиями вывести. Причем процесс состоит из использования максимально доступных ингредиентов. А все действия могут осуществлять даже самые неопытные домохозяйки.
Как одевается итальянская бабушка — самая сексуальная женщина Инстаграм
Почему выбрасывать подушку — плохо. Правила энергетики
Понравилась статья? Поделиться с друзьями:
Автор статьи:
Анастасия Музычко
Считаю, что самый волшебный процесс в создании статьи начинается от идеи и заканчивается её воплощением в жизнь.
Задать вопрос автору
Как убрать след от утюга на ковре —
22.11.2019Ткани и материалыКомментарии: 0Содержание
- 1 Как убрать небольшие подпалины на ковре от утюга
- 1.1 Вам понадобятся:
- 1.2 Как обрезать сгоревший ворс
- 2 Замена участка ковра с сильными подпалинами
- 2.1 Вам понадобятся:
- 2.2 Как заменить сгоревший участок ковра
- 3 Как убрать пятно от утюга на ковре
- 3.1 Вам понадобятся:
- 3.2 Как удалить след от утюга на ковре
- 4 Дополнительные советы Как убрать след от утюга
Как убрать след от утюга на ковре? Ковер или ковролин в наших домах занимает большую площадь на полу и подвергается ежедневным физическим воздействиям. Мы ходим по нему, лежим, пылесосим, а иногда он служит нам совершенно не по предназначению – например, вместо гладильной доски. Горячая подошва утюга несёт опасность для ворса ковра, потому как высокая температура способна повредить его. Случайное падение включенного утюга может оставить заметный след на ковре. Такие пятна (подпалины) могут иметь разную степень повреждения, в зависимости от времени соприкосновения горячей подошвы и коврового покрытия. Если утюг находился на ковре не более секунды, повреждаются лишь самые верхушки волокон. Это не самое сложное повреждение – верхушки оплавленных волокон можно просто обрезать. В некоторых случаях утюг падает так, что сжигает значительную длину ворса. Это наиболее сложное повреждение, так как требует замены части коврового покрытия. Самый простой случай, когда ворс не повреждается вообще, а есть только небольшие следы от утюга на ковре – их можно без особого труда удалить. Следуйте приведенным ниже инструкциям, чтобы получить наилучшие результаты.
Горячая подошва утюга несёт опасность для ворса ковра, потому как высокая температура способна повредить его. Случайное падение включенного утюга может оставить заметный след на ковре. Такие пятна (подпалины) могут иметь разную степень повреждения, в зависимости от времени соприкосновения горячей подошвы и коврового покрытия. Если утюг находился на ковре не более секунды, повреждаются лишь самые верхушки волокон. Это не самое сложное повреждение – верхушки оплавленных волокон можно просто обрезать. В некоторых случаях утюг падает так, что сжигает значительную длину ворса. Это наиболее сложное повреждение, так как требует замены части коврового покрытия. Самый простой случай, когда ворс не повреждается вообще, а есть только небольшие следы от утюга на ковре – их можно без особого труда удалить. Следуйте приведенным ниже инструкциям, чтобы получить наилучшие результаты.
Как убрать небольшие подпалины на ковре от утюга
Вам понадобятся:
- Ножницы
- Наждачная бумага
- Пылесос
- Широкозубчатый гребешок (расческа)
Как обрезать сгоревший ворс
- Отшлифуйте пятно от утюга на ковре наждачной бумагой.

- Пропылесосьте обработанный участок.
- Удалите оставшиеся сгоревшие черные волокна, вырезая их ножницами.
- Расчешите очищенную зону с помощью широкозубчатого гребешка, чтобы восстановить расположение ворса таким, как на других участках ковра.
- Если убрать подпалины от утюга на ковре полностью не получилось, следуйте указаниям ниже.
- Если вы поймёте, что ковёр был повреждён сильнее, чем вы изначально думали, и/или удаление сгоревших волокон создаёт заметное пятно, перейдите к следующему разделу.
Замена участка ковра с сильными подпалинами
Вам понадобятся:
- Кусок соответствующего коврового покрытия (по размеру не меньший, чем повреждённый участок) – это может быть оставшийся обрезок ковролина или купленный подходящий кусок в магазине ковров
- Ножницы
- Канцелярский нож
- Клей для ковров или двухсторонняя ковровая лента (двухсторонний скотч)
- Пылесос
- Бумага
- Тяжелая книга
- Широкозубчатый гребешок (расческа)
Как заменить сгоревший участок ковра
- Пропылесосьте след от утюга на ковре, чтобы вы могли начать с чистой рабочей зоны.

- С помощью канцелярского ножа тщательно вырежьте участок ковра с сильными подпалинами. Резать надо достаточно глубоко, чтобы прорезать ковровое покрытие, но не прорезать подкладку под ним.
- Затем снимите срезанный участок ковра. Найдите кусок коврового покрытия, который максимально будет совпадать по фактуре и размеру. Обращайте внимание на направление ворса на заплатке – оно должно совпадать с направлением ворса на ремонтируемом ковре. Всё это поможет новой заплатке слиться с остальным ковровым покрытием.
- Используйте удалённый участок ковра как шаблон, чтобы вырезать такого же размера и формы кусок нового коврового покрытия.
- Пропылесосьте обработанный участок ковра, чтобы очистить его от остатков срезанных волокон и ворса.
- Поместите подготовленный кусок нового коврового покрытия на срезанный участок и аккуратно подрежьте его выступающие края, чтобы максимально подогнать заплатку по размеру и форме.
- Когда заплатка будет готова к установке, закрепите на подкладке ковра двухсторонний скотч или промажьте её клеем.

- Положите ковровую заплатку на клей (скотч) и убедитесь, что узоры и направление ворса выровнены. Придавите наклеиваемый кусок.
- Накройте ковровую заплатку тяжёлой книгой, чтобы пока клей будет высыхать она никуда не сдвинулась. (Если используется двухсторонний скотч, перейдите к шагу 11).
- Прежде чем убирать книгу, дождитесь высыхания клеевого соединения в течение нескольких часов.
- Уберите книгу и аккуратно расчешите ковер широкозубчатым гребешком – это объединит новый кусок со старым ковровым покрытием.
Как убрать пятно от утюга на ковре
След от утюга на ковре может быть незначительным вследствие того, что ковровый ворс только немного изменил цвет от воздействия высокой температуры, а не сгорел или обуглился. Вот как вывести пятно от утюга на ковре.
Вам понадобятся:
- Очищающий раствор (1 часть перекиси водорода на 10 частей воды – такой раствор безопасен для ковровых покрытий с натуральным и синтетическим ворсом), используйте обычную аптечную 3% перекись
- Мягкая тряпка или губка
- Вода
Как удалить след от утюга на ковре
- Если на ковре остался след от утюга, смочите тряпку чистящим раствором и сотрите его, двигаясь от краев к середине пятна.

- Повторяйте процесс до тех пор, пока полностью не удалите с ковра пятно от утюга.
- Обрызгайте очищенный участок чистой водой, чтобы промыть его.
- Протрите ковер чистой сухой тканью и дайте полностью высохнуть.
Дополнительные советы Как убрать след от утюга
- Для небольших прожженных пятен, например, от сигарет, смотрите нашу статью «Как убрать прожженное пятно с ковра».
- Если вы не уверены в своих силах или вам сложно выполнить приведенные инструкции, обращайтесь к профессионалам по ремонту ковров (объявлений в Интернете по данной услуге предостаточно).
Статус микроэлементов (железо, цинк, медь, хром, кобальт и никель) при железодефицитной анемии у детей в возрасте до 3 лет
Анемия. 2014; 2014: 718089.
Опубликовано в Интернете 26 февраля 2014 г. doi: 10.1155/2014/718089
, 1 , * , 2 , 3 , 4 , 2 и 1
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственности
Цель . Определить микроэлементный статус и этиологические факторы развития дефицита микроэлементов у детей с железодефицитной анемией (ЖДА) в возрасте от 0 до 3 лет. Контингент и методы . 30 пациентов университетской больницы, г. Плевен, Болгария — I группа; 48 больных Сумской областной детской клинической больницы, г. Сумы, Украина — II группа; Было исследовано 25 здоровых контролей. Концентрации железа, цинка, меди, хрома, кобальта и никеля в сыворотке определяли спектрофотометрически и атомно-абсорбционной спектрофотометрией. Результаты . Поскольку полученные уровни цинка, меди и хрома в сыворотке были близки к нижним референтным пределам, I группа была разделена на IA и IB. В группе ИА сывороточные концентрации были ниже референтных значений у 47%, 57% и 73% пациентов соответственно. В группе ИБ они были в пределах референтных значений. Во II группе результаты по цинку, кобальту и никелю были достоверно ниже ( P < 0,05), а результаты по меди достоверно выше по сравнению с контролем.
Определить микроэлементный статус и этиологические факторы развития дефицита микроэлементов у детей с железодефицитной анемией (ЖДА) в возрасте от 0 до 3 лет. Контингент и методы . 30 пациентов университетской больницы, г. Плевен, Болгария — I группа; 48 больных Сумской областной детской клинической больницы, г. Сумы, Украина — II группа; Было исследовано 25 здоровых контролей. Концентрации железа, цинка, меди, хрома, кобальта и никеля в сыворотке определяли спектрофотометрически и атомно-абсорбционной спектрофотометрией. Результаты . Поскольку полученные уровни цинка, меди и хрома в сыворотке были близки к нижним референтным пределам, I группа была разделена на IA и IB. В группе ИА сывороточные концентрации были ниже референтных значений у 47%, 57% и 73% пациентов соответственно. В группе ИБ они были в пределах референтных значений. Во II группе результаты по цинку, кобальту и никелю были достоверно ниже ( P < 0,05), а результаты по меди достоверно выше по сравнению с контролем. Заключение . Низкие концентрации цинка, меди, кобальта и никеля в сыворотке были в основном связаны с неадекватным питанием, мальабсорбцией и взаимодействием питательных микроэлементов в обеих исследуемых группах. Повышение содержания меди в сыворотке крови во II группе, вероятно, было связано с метаболическими изменениями в результате адаптации ЖДА. Данные могут быть использованы для разработки алгоритма диагностики ЖДА.
Заключение . Низкие концентрации цинка, меди, кобальта и никеля в сыворотке были в основном связаны с неадекватным питанием, мальабсорбцией и взаимодействием питательных микроэлементов в обеих исследуемых группах. Повышение содержания меди в сыворотке крови во II группе, вероятно, было связано с метаболическими изменениями в результате адаптации ЖДА. Данные могут быть использованы для разработки алгоритма диагностики ЖДА.
В условиях железодефицитной анемии (ЖДА) происходит множество метаболических изменений, представляющих собой адаптационные механизмы для максимизации доставки железа для эритропоэза [1, 2]. Между метаболизмом различных микроэлементов, в том числе и железа, существуют тесные связи, основанные на антагонистических или синергических взаимодействиях [3, 4]. Одно из известных звеньев находится на уровне общих кишечных транспортеров железа и других двухвалентных металлов. Активация их экспрессии, вызванная дефицитом железа (ЖД), предрасполагает к метаболическим дисбалансам и соответствующим изменениям статуса микроэлементов [1, 2]. Другая известная связь находится на уровне белков-запасников металлов, металлотионеинов, которые связывают различные металлы, действуя, таким образом, в их запасании и детоксикации [5-7].
Другая известная связь находится на уровне белков-запасников металлов, металлотионеинов, которые связывают различные металлы, действуя, таким образом, в их запасании и детоксикации [5-7].
Взаимодействие различных микроэлементов с железом определяет взаимосвязь между изменением статуса микроэлементов в организме и развитием ЖДА. Повышение содержания антагонистических по отношению к железу микроэлементов, таких как кобальт, цинк, медь, хром и кальций, нарушающих всасывание железа или его физиологическое воздействие, может привести к развитию ЖДА. Дефицит синергических по отношению к железу микроэлементов, участвующих в метаболизме железа или процессах кроветворения, таких как медь, хром, никель, натрий и калий, может существенно способствовать этиологии ЖДА [4].
Только 35–55% случаев ЖДА у детей обусловлены исключительно дефицитом железа, а другие связаны с изменениями статуса многих микроэлементов.
В нашем исследовании мы используем концентрации микроэлементов в сыворотке в качестве маркеров статуса микроэлементов в организме.
Результаты, опубликованные разными исследователями о статусе микроэлементов в ЖДА, различны и часто противоречат друг другу.
Большинство исследователей обнаружили более низкие уровни цинка в сыворотке у субъектов с ЖДА по сравнению с субъектами без анемии [8–11], но другие не обнаружили существенных различий в уровне цинка в сыворотке между субъектами ЖДА и здоровыми людьми [12–14].
При изучении содержания меди в сыворотке и крови у лиц с ДЖ и анемией обнаружены более высокие [8–10, 12, 15] и более низкие уровни [16, 17], а также уровни без достоверных различий [13, 14] по сравнению с пациентами без анемии и с адекватным содержанием железа. Как низкие, так и высокие концентрации меди в сыворотке наблюдались у подгруппы участников с анемией в исследовании Knovich et al. [18].
Хотя хром считается синергетическим по отношению к железу [4] и некоторые исследователи обнаружили более низкие концентрации в крови пациентов с анемией по сравнению с контрольными субъектами [17], это известно как антагонистическая конкуренция между трехвалентным хромом и трехвалентным железом за связывание с апотрансферрином. [4, 19]. На основе этого взаимодействия Lukaski et al. предположили неблагоприятное влияние высоких доз и длительного приема хрома на метаболизм железа и статус у взрослых [20].
[4, 19]. На основе этого взаимодействия Lukaski et al. предположили неблагоприятное влияние высоких доз и длительного приема хрома на метаболизм железа и статус у взрослых [20].
Кобальт и никель — эссенциальные микроэлементы, оказывающие существенное влияние на процессы кроветворения — стимуляция продукции эритропоэтина и синтеза гемоглобина [21]. Более низкие концентрации никеля наблюдались в крови детей с анемией по сравнению со здоровыми людьми [17]. Более высокие концентрации кобальта были обнаружены в крови при низких запасах железа в организме [2].
Наш литературный поиск показывает, что многие исследователи не объясняют изменения в статусе микроэлементов механизмами транспортировки и хранения.
Цель исследования — определение микроэлементного статуса, этиологических факторов и механизмов развития дефицита микроэлементов у детей с ЖДА от 0 до 3 лет.
В нашем исследовании приняли участие 78 пациентов в возрасте от 0 до 3 лет с клинико-лабораторными признаками ЖДА. 30 детей-пациентов Университетской больницы Медицинского университета, г. Плевен, Болгария — I группа и 48 — пациенты Сумской областной детской клинической больницы, г. Сумы, Украина — II группа. В группу сравнения вошли 25 здоровых детей того же возраста.
30 детей-пациентов Университетской больницы Медицинского университета, г. Плевен, Болгария — I группа и 48 — пациенты Сумской областной детской клинической больницы, г. Сумы, Украина — II группа. В группу сравнения вошли 25 здоровых детей того же возраста.
Анемия определяется в соответствии с критериями, принятыми ВОЗ. В качестве диагностических пределов анемии использовали уровень гемоглобина ниже 110 г/л и значение гематокрита ниже 0,33 л/л. В I группе пациентов для определения того, что анемия обусловлена ДЖ, использовались показатели статуса железа, особенно концентрации железа в сыворотке ниже 8,0 мк моль/л и насыщения трансферрина (TS) ниже 16%, а также низкие показатели эритроцитов [22]. ]. Процент ПС рассчитывали как отношение железа сыворотки к общей железосвязывающей способности (ЖСС) — железо сыворотки/ОЖСС × 100. Показатели ферритина сыворотки использовали в качестве показателей дефицита железа во II группе.
Все дети были включены в исследование после информированного согласия их родителей или опекунов. Этическое одобрение было получено от комитетов по этике институциональных исследований.
Этическое одобрение было получено от комитетов по этике институциональных исследований.
Родительский вопросник был предоставлен для сбора информации о характере питания.
Образцы венозной крови натощак были взяты для анализа утром у всех детей в стерильные пробирки, необработанные гепарином, ЭДТА, цитратом и т.д. После двухчасового стояния и центрифугирования при 3500 об/мин в течение 10 минут отделяли сыворотку крови. Образцы сыворотки помещали в закрытые пластиковые лабораторные сосуды и хранили при температуре -18°С до анализа на микроэлементы.
В I группе содержание микроэлементов железа, цинка, меди и хрома в сыворотке крови определяли спектрофотометрически: феррозиновый метод [23] для сывороточного железа и общей железосвязывающей способности на анализаторе COBAS INTEGRA 400 (Roche), спектрофотометрические методы на GIESSE диагностические тесты (Италия) на цинк в сыворотке и диагностические тесты AUDIT (Ирландия) на медь в сыворотке и спектрофотометрический метод [24] с нашими модификациями на хром в сыворотке. Концентрации цинка, меди и хрома в сыворотке крови определяли на спектрофотометре DR2800 (Hach Lange, Германия).
Концентрации цинка, меди и хрома в сыворотке крови определяли на спектрофотометре DR2800 (Hach Lange, Германия).
Уровни ферритина в сыворотке определяли методом ИФА с использованием набора реагентов «UBI MAGIVEL FERRITIN» производства «United Biotech Inc.» (США).
Гематологические параметры, такие как гемоглобин (Hb), гематокрит (Ht), количество эритроцитов (RBC) и индексы эритроцитов, средний корпускулярный объем (MCV), средний корпускулярный гемоглобин ( МСН ), средняя концентрация корпускулярного гемоглобина ( МСН С ), ширину распределения эритроцитов (RDW) исследовали на анализаторе МИКРОС-18 (ABX). Количество ретикулоцитов определяли при микроскопическом исследовании мазка периферической крови, окрашенного суправитальным красителем.
Концентрации микроэлементов в сыворотке и гематологические параметры в I группе пациентов сравнивали с их соответствующими референтными значениями, указанными в .
Таблица 1
Гематологические показатели и содержание микроэлементов в сыворотке крови детей с ЖДА.
| Параметр | Справочные значения | I Группа с IDA ( N = 30) | II Группа с IDA ( N = 48) | Comparison group ( n = 25) | |
|---|---|---|---|---|---|
| Mean [27, 28] | −2 SD [27, 28] | ||||
| Haemoglobin (g/L) | 120 | 105 | 90.23 ± 11.09 | 89.79 ± 1.23 | 119.15 ± 2. 41 41 |
| Haematocrit (L/L) | 0.36 | 0.33 | 0.279 ± 0.029 | 0.301 ± 0.004 | 0.3442 ± 0.006 |
| RBC (×10 12 cells/L) | 4.5 | 3.7 | 4.41 ± 0.65 | 3.58 ± 0.05 | 4.07 ± 0.12 |
| Rtc ( Ğ ) | 10 [28] | — | — | 5. 5 ± 0.87 5 ± 0.87 | 7.86 ± 0.98 |
| MCV (fL) | 78 | 70 | 64.3 ± 9.87 | 74.66 ± 1.08 | 82.52 ± 1.17 |
| MCH (pg) | 27 | 23 | 20,93 ± 4.17 | 24.77 ± 0.39 | 29.82 ± 0.56 |
| MCHC (g/L) | 330 | 300 | 322. 67 ± 18.16 67 ± 18.16 | 323.47 ± 4.34 | 365.17 ± 3.6 |
| RDW ( %) | 1.5–15 [29] | 15.58 ± 1.56 | — | — | |
| Iron ( μ mol/L) | 8.0–24.0 [30] | 4.43 ± 1.21 | 9.23 ± 0,86 | 22,92 ± 1,83 | |
| Zinc ( μ mol/L) | 11.1–19.5 [5, 31] | 11.22 ± 4. 40 40 | 11.02 ± 1.79 | 17.96 ± 1.06 | |
| Copper ( μ mol/L) | 11.0–24.0 [6, 32] | 11.81 ± 4.39 | 23.80 ± 0.76 | 16.50 ± 0.71 | |
| Chromium ( μ mol/L) | 0.95–9.5 [33] | 0.83 ± 0.69 | — | — | |
| Кобальт ( мкм mol/L × 10 −3 ) | 0.00–15.25 [34] | — | 5. 74 ± 0.76 74 ± 0.76 | 9.16 ± 0.61 | |
| Nickel ( μ mol/L × 10 −3 ) | 1,70–10,22 [35] | — | 8,99 ± 0,868 | 14,35 ± 1,09 | |
Open в отдельном окне
Open в отдельном окне
. кобальт и никель в сыворотке крови и эритроцитах определяли методом атомно-абсорбционной спектрофотометрии (ААС) на спектрофотометре С-115 М1 (ОАО «Селми», Украина) [25, 26]. Все результаты микроэлементного анализа и исследуемые гематологические показатели у больных II группы сравнивали со здоровым контролем. Содержание микроэлементов в сыворотке крови и эритроцитах в группе сравнения определяли методом ААС.
Статистическую обработку данных проводили с помощью Excel (Microsoft Corporation, Redmond, WA), Statgraphics Plus (Manugistics, Rockville, MD) и Statistica 6. 1 (StatSoft, США). Все значения были выражены как среднее ± стандартное отклонение (SD). Для оценки различий между исследуемыми группами использовали тест Стьюдента t и критерий Вилкоксона. На статистически значимые различия указывали значения P <0,05.
1 (StatSoft, США). Все значения были выражены как среднее ± стандартное отклонение (SD). Для оценки различий между исследуемыми группами использовали тест Стьюдента t и критерий Вилкоксона. На статистически значимые различия указывали значения P <0,05.
Клинические проявления ЖДА у всех детей проявлялись наличием сидеропенического и анемического синдромов.
Анемический синдром проявляется такими симптомами, как бледность кожи и слизистых оболочек, утомляемость и обморок, тахикардия, систолический шум. У ряда больных наблюдались апатия, сонливость или, наоборот, чрезмерная раздражительность, эмоциональная лабильность из-за снижения доставки кислорода к мозгу [36] и дефицита железа, которое, как показано, играет ключевую роль в функциях мозга [22]. .
Проявления гипосидероза обусловлены дефицитом железосодержащих ферментов. Наблюдалась сухость кожи, изменение волос — ломкость, тусклый цвет; также были обнаружены признаки ангулярного стоматита и атрофического глоссита. Большинство детей страдали от потери аппетита. У ряда больных отмечался синдром мышечной гипотонии. У части больных ЖДА наблюдалось увеличение размеров печени и селезенки за счет экстрамедуллярного кроветворения (рисунки и ).
Большинство детей страдали от потери аппетита. У ряда больных отмечался синдром мышечной гипотонии. У части больных ЖДА наблюдалось увеличение размеров печени и селезенки за счет экстрамедуллярного кроветворения (рисунки и ).
Открыть в отдельном окне
Клинические признаки ЖДА I группы (а) и II группы (б).
Результаты исследованных клинико-лабораторных показателей у больных ЖДА группы сравнения и соответствующие референсные значения представлены в .
Все гематологические показатели у детей с анемией изменялись в соответствии с наличием ЖДА. Среднее значение сывороточного железа в I группе больных ЖДА оказалось ниже референсных значений — 4,43 ± 1,21 μ моль/л (, ) и наряду с низкой насыщенностью трансферрина (TS) -6,23 ± 2,65% указывали на наличие ID. Во II группе содержание ферритина в сыворотке крови составило 9,42 ± 0,75 нг/мл, что значительно ниже ( P < 0,001) по сравнению со здоровым контролем -38,67 ± 4,18 нг/мл.
Открыть в отдельном окне
Сывороточные концентрации микроэлементов в I группе (а) и II группе (б) детей с ЖДА.
Средние значения цинка, меди и хрома в сыворотке крови в I группе были близки к нижним пределам референтных диапазонов (, ). Во II группе пациентов с ЖДА средние концентрации железа, цинка, кобальта и никеля в сыворотке крови оказались значительно ниже, а средний уровень меди в сыворотке достоверно выше по сравнению с контрольной группой (, ) с уровнем достоверности 9.0025 Р < 0,05.
В I группе результаты сывороточных уровней цинка, меди и хрома (, ) позволяют разделить обследованных на две группы по каждому из исследуемых микроэлементов ().
Открыть в отдельном окне
Концентрации цинка, меди и хрома в сыворотке крови детей с ЖДА группы IA и IB.
Пациенты с концентрацией микроэлементов в сыворотке крови ниже референсных значений – цинк сыворотки 7,29 ± 2,54 мк моль/л, медь 8,6 ± 1,46 мк моль/л и хром 0,47 ± 0,14 мк моль/л входят в группу IA. По каждому из исследованных микроэлементов количество больных в этой группе составляет 47% ( n = 14), 57% ( n = 17) и 73% ( n = 22) от общего числа больных. дети с ЖДА I группы.
дети с ЖДА I группы.
Пациенты с концентрацией микроэлементов в сыворотке крови в пределах референсных значений – цинка в сыворотке 14,65 ± 2,21 мк моль/л, меди 16,0 ± 3,2 мк моль/л и хрома 1,83 ± 0,61 мк моль/л, входят в группу IB. По каждому из исследованных микроэлементов количество больных в этой группе составляет 53% ( n = 16), 43% ( n = 13) и 27% ( n = 8) от общего числа больных. участники с ЖДА в I группе.
Имеются статистически значимые различия между группами IA и IB ( P < 0,001).
Исследование содержания микроэлементов в эритроцитах показало достоверно более низкие значения всех исследованных микроэлементов у больных ЖДА по сравнению с контрольной группой ().
Таблица 2
Содержание микроэлемента в эритроцитах детей с ЖДА и контрольной группы.
| Trace element content ( μ g/mg ash) | II group with IDA ( n = 48) | Comparison group ( n = 25) |
|---|---|---|
| Железо* | 15,58 ± 1,13 | 31,56 ± 1,65 |
| Цинк* | 0,208 ± 0,013 | 0. 260 ± 0.012 260 ± 0.012 |
| Copper* | 0.176 ± 0.016 | 0.271 ± 0.039 |
| Cobalt* | 0.0316 ± 0.0023 | 0.0411 ± 0.0034 |
| Nickel* | 0.0330 ± 0.0023 | 0.0500 ± 0,0034 |
Открыть в отдельном окне
*Уровень надежности P < 0,05.
В условиях ЖДА на статус микроэлементов в организме в значительной степени влияют метаболические взаимодействия между микроэлементами, некоторые из которых являются результатом адаптационных механизмов для максимизации доставки железа для эритропоэза [1, 2, 22]. Питание, физиологические особенности в разные периоды жизни и сопутствующие патологические состояния также влияют на статус микроэлементов. Показано, что дети в младенчестве и раннем детстве особенно подвержены дефициту железа и цинка, а дефицит меди возникает в основном в младенчестве. Эта уязвимость связана с повышенными потребностями в быстром росте, которые часто не удовлетворяются диетой [6, 17, 22, 36, 37].
Питание, физиологические особенности в разные периоды жизни и сопутствующие патологические состояния также влияют на статус микроэлементов. Показано, что дети в младенчестве и раннем детстве особенно подвержены дефициту железа и цинка, а дефицит меди возникает в основном в младенчестве. Эта уязвимость связана с повышенными потребностями в быстром росте, которые часто не удовлетворяются диетой [6, 17, 22, 36, 37].
ЖДА часто ассоциируется с низким уровнем цинка в сыворотке крови, а также с дефицитом цинка [8–10]. В нашем исследовании полученные значения сывороточного цинка у пациентов с ЖДА также были ниже по сравнению с контрольными значениями и контролем (рисунки и ). Эти изменения в статусе цинка часто объясняются сосуществующим дефицитом железа и цинка из-за общих пищевых источников обоих микроэлементов и снижения их всасывания в кишечнике из-за одних и тех же диетических факторов [9, 11].
Более низкие уровни меди в сыворотке, чем референтные значения, были также получены для большинства пациентов в I группе (57%, н = 17).
В ходе нашего исследования мы обнаружили ряд факторов, связанных с низкими концентрациями цинка и меди в сыворотке крови у детей с ЖДА.
У 20% детей с ЖДА I группы в анамнезе были преждевременные роды или низкая масса тела при рождении, которые являются важными факторами дефицита цинка и меди из-за неадекватных пренатальных запасов и повышенных потребностей для роста [6, 38] .
Связь между коротким периодом грудного вскармливания, кормлением исключительно коровьим молоком и низким уровнем цинка в сыворотке крови наблюдалась у 57,14% пациенток группы ИА. Связь одних и тех же диетических факторов с низким уровнем меди в сыворотке крови отмечена у 64,7% пациентов группы ИИ. Эта взаимосвязь, вероятно, может быть связана с более низкой биодоступностью цинка и меди из коровьего молока по сравнению с грудным молоком и низким содержанием меди в коровьем молоке [5–7, 38, 39].].
Мальабсорбция вследствие энтеропатии, вызванной белками коровьего молока, может рассматриваться как фактор развития дефицита микронутриентов у 10% больных ЖДА [5, 6, 18, 37].
Низкие концентрации цинка и меди в сыворотке крови у некоторых обследованных детей могут быть связаны с неадекватным потреблением продуктов с высокой биодоступностью цинка и меди — мяса, птицы и рыбы, которые являются важными пищевыми источниками цинка и меди у детей. диета [5, 15, 39, 40]. Другим диетическим фактором является раннее введение и высокое потребление продуктов на основе муки, содержащих ингибиторы фитатов цинка и меди [7, 17]. Эти диетические факторы наблюдались у 78,6% больных с низким содержанием цинка в сыворотке крови и у 76,47% больных с низким содержанием меди в сыворотке крови I группы.
Предполагаемые механизмы, объясняющие низкие уровни цинка и меди в сыворотке крови у некоторых исследованных детей, представляют собой антагонистические взаимодействия между цинком и медью внутри энтероцита [7]. Нарушение всасывания цинка в кишечнике наблюдается в условиях высокого потребления меди, что связано с конкурентным антагонизмом между обоими металлами за места всасывания в желудочно-кишечном тракте [3, 5].
При относительно высоком потреблении цинка с пищей индуцируется продукция металлосвязывающих белков металлотионеинов в слизистой оболочке кишечника. Поскольку металлотионеины имеют большее сродство к меди, чем к цинку, за этим следует секвестрация высокой доли пищевой меди в стабильном комплексе медь-металлотионин в клетках слизистой оболочки кишечника — «блокировка слизистой оболочки» в транспорте меди, снижение всасывания меди и увеличение содержания меди в организме. экскреция [5, 7].
Низкие концентрации цинка и меди в сыворотке крови, обнаруженные нами у обследованных детей, могут рассматриваться как способствующие факторы ЖДА в связи с известным синергическим взаимодействием обоих микроэлементов с железом — участием цинка в синтезе гемоглобина и его эссенциальной ролью в эритропоэзе [7]. , 41], участие медьсодержащих ферментов церулоплазмина и гефестина, феррохелатазы и цитохром-с-оксидазы в обмене железа, образовании гемоглобина и механизмах кроветворения [4, 6, 7, 42]. Исследования на животных и людях показали, что дефицит меди может приводить к ДЖ [1, 4] и ЖДА [6, 7, 43].
Исследования на животных и людях показали, что дефицит меди может приводить к ДЖ [1, 4] и ЖДА [6, 7, 43].
Трудно выявить факторы, объясняющие относительно высокие уровни цинка в сыворотке крови, обнаруженные у некоторых больных ЖДА из группы ИБ, а также их связь с развитием ЖДА. Некоторые исследования показали, что дефицит железа в питании усиливает всасывание цинка в кишечнике, предполагая, что переносчик двухвалентных металлов 1 (DMT1) является общим путем всасывания обоих металлов и физиологической основой для такого взаимодействия [44]. Хотя цинк считается антагонистом железа [4] на основании конкуренции за абсорбцию, в исследованиях, оценивающих влияние цинка на абсорбцию железа, были получены противоречивые результаты, а DMT1 был постулирован как маловероятный сайт для конкурентного антагонизма [7].
Обнаружение значительно более высокого содержания меди в сыворотке крови у пациентов II группы с ЖДА по сравнению со здоровым контролем и относительно высокое содержание меди в сыворотке в части группы ИБ можно рассматривать как следствие адаптационных механизмов при ДЖ, направленных на максимизацию доставки железа для эритропоэза [1]. ]. Имеются данные об усилении дуоденального переносчика железа DMT1, который также является физиологически значимым переносчиком меди, и медь-АТФазы Менкеса (белок MNK, Atp7a) на базолатеральной мембране энтероцитов в условиях низкого содержания железа [1, 2, 13].
]. Имеются данные об усилении дуоденального переносчика железа DMT1, который также является физиологически значимым переносчиком меди, и медь-АТФазы Менкеса (белок MNK, Atp7a) на базолатеральной мембране энтероцитов в условиях низкого содержания железа [1, 2, 13].
Было показано, что повышенная абсорбция меди, вызванная ДЖ, может способствовать ЖДА [12] из-за известной антагонистической конкуренции между медью и железом на уровне ДМТ1 [4, 8]. Кроме того, более высокие концентрации меди в сыворотке связаны с высокими уровнями церулоплазмина в сыворотке, который из-за антагонизма с цинком снижает соотношение цинка и меди (Zn : Cu). Известно, что это увеличивает гемолиз и перекисное окисление эритроцитов и тем самым способствует развитию анемии [7, 43]. Таким образом, более высокий уровень меди в сыворотке крови у пациентов II группы и относительно высокий, хотя и находящийся в пределах референсных значений, уровень меди в сыворотке крови группы ИБ можно рассматривать как важный фактор, способствующий развитию ЖДА.
Кроме того, во II группе детей с ЖДА наблюдался дисбаланс эритроцитарной и сывороточной меди со значительным повышением ее концентрации в сыворотке крови, но дефицитом меди в эритроцитах (). Известно, что дефицит меди в эритроцитах нарушает включение железа в структуру гема [43].
Концентрация хрома в сыворотке крови ниже референсных значений у 73% детей с ЖДА I группы. Другие исследователи [17] также обнаружили значительно более низкие концентрации хрома в крови больных анемией по сравнению с контрольной группой. Хром считается синергистом железа, и его дефицит может привести к ДЖ [4]. У остальных 27% больных ЖДА I группы концентрации хрома в сыворотке крови были в пределах референсных значений. Это объясняется тем, что помимо синергизма хром может быть антагонистом железа из-за конкуренции за связывание с апотрансферрином. Значительно сниженное поглощение железа сывороточным трансферрином наблюдалось в присутствии хрома [4, 19].]. Следовательно, у этих детей обнаруженные уровни хрома в сыворотке могут быть связаны с негативным влиянием хрома на метаболизм железа, что способствует этиологии ЖДА.
Средние концентрации как кобальта, так и никеля в сыворотке крови в нашем исследовании оказались значительно ниже у детей с ЖДА, чем у здоровых людей ( P < 0,05). Кобальт и никель играют важную роль в процессах эритропоэза. Было показано, что оба металла стимулируют выработку эритропоэтина за счет активации фактора транскрипции, индуцируемого гипоксией, фактора 1, 9.0025 α (HIF-1 α ). Кобальт влияет на синтез ДНК, ускоряя созревание эритроидных стволовых клеток и стимулируя синтез гемоглобина [21, 45]. Никель считается синергистом железа, способствуя его всасыванию в кишечнике, а дефицит никеля может привести к ДЖ и анемии [4, 17, 46]. Следовательно, дефицит обоих микроэлементов может быть фактором, способствующим развитию ЖДА в нашем исследовании.
Однако трудно определить факторы, объясняющие эти результаты, потому что, хотя уровни кобальта и никеля в сыворотке оказались ниже, чем у контрольных субъектов, они были в пределах контрольных значений. Было показано, что всасывание железа, кобальта и никеля в кишечнике опосредуется общим транспортным механизмом, DMT1 [2, 47], который, как известно, активируется ID [2, 13]. Однако было обнаружено, что транспортная способность кобальта и никеля была ниже, чем у железа, из-за более высокой константы связи и более низкой скорости обмена для обоих металлов по сравнению с железом. Вероятно, это не только приводит к подавлению дуоденального поглощения железа, но также объясняет более низкие уровни кобальта и никеля, которые мы наблюдали у детей с ЖДА [21].
Было показано, что всасывание железа, кобальта и никеля в кишечнике опосредуется общим транспортным механизмом, DMT1 [2, 47], который, как известно, активируется ID [2, 13]. Однако было обнаружено, что транспортная способность кобальта и никеля была ниже, чем у железа, из-за более высокой константы связи и более низкой скорости обмена для обоих металлов по сравнению с железом. Вероятно, это не только приводит к подавлению дуоденального поглощения железа, но также объясняет более низкие уровни кобальта и никеля, которые мы наблюдали у детей с ЖДА [21].
Мы также обнаружили, что диетические факторы и мальабсорбция могут рассматриваться как связанные с более низкими концентрациями кобальта и никеля в сыворотке крови у наших пациентов с ЖДА. Важными пищевыми источниками кобальта являются ткани или продукты животного происхождения, такие как мясо, яйца и молочные продукты, которых оказалось мало в рационе детей с ЖДА. Высокое потребление коровьего молока с пищей, часто наблюдающееся у детей грудного и раннего возраста и обнаруживаемое как обычная диета у наших больных ЖДА, не обязательно обеспечивает достаточное потребление кобальта из-за известного геохимического дефицита кобальта. Поскольку коровье молоко имеет низкое содержание никеля и содержит факторы, препятствующие всасыванию никеля, модели питания на основе коровьего молока, наблюдаемые в нашем исследовании, могут быть возможной причиной обнаруженных более низких уровней никеля в сыворотке крови. Кишечная мальабсорбция, обнаруживаемая у некоторых пациентов с ЖДА, также известна как способствующая низкому содержанию кобальта и никеля в организме [48–50].
Поскольку коровье молоко имеет низкое содержание никеля и содержит факторы, препятствующие всасыванию никеля, модели питания на основе коровьего молока, наблюдаемые в нашем исследовании, могут быть возможной причиной обнаруженных более низких уровней никеля в сыворотке крови. Кишечная мальабсорбция, обнаруживаемая у некоторых пациентов с ЖДА, также известна как способствующая низкому содержанию кобальта и никеля в организме [48–50].
С помощью настоящего исследования, включающего исследование статуса микроэлементов, мы расширяем этиологию ЖДА. Полученные данные могут быть использованы для разработки алгоритма диагностики ЖДА.
Низкие концентрации микроэлементов цинка, меди, кобальта и никеля в сыворотке крови, в основном из-за неадекватного питания, проблем с мальабсорбцией и взаимодействия микроэлементов, были обнаружены в обеих исследуемых группах (I и II группы) детей с ЖДА.
Профили микроэлементов железа и цинка в сыворотке крови не различаются в двух исследуемых группах по двум примененным аналитическим методам. Повышение концентрации меди в сыворотке крови во II группе по сравнению с контрольной группой, вероятно, связано с метаболическими изменениями, возникающими в результате механизмов адаптации при ЖДА.
Повышение концентрации меди в сыворотке крови во II группе по сравнению с контрольной группой, вероятно, связано с метаболическими изменениями, возникающими в результате механизмов адаптации при ЖДА.
Недостаточность микронутриентов в рационе, а также низкие концентрации микроэлементов в сыворотке крови часто встречаются у детей с ЖДА в возрасте до 3 лет. Однако механизмы метаболических взаимодействий микроэлементов на основе транспортных и запасающих молекул еще недостаточно изучены. Дефицит микронутриентов у больных ЖДА может приводить к формированию так называемого связанного функционального дефицита железа. В этом случае считается, что молекулярные механизмы, обеспечиваемые микроэлементами, ответственными за всасывание и транспорт железа и в дальнейшем включающиеся в структуру гема, вероятно, нарушены. Это может привести к низкой эффективности монотерапии препаратами железа.
Высокая распространенность связанных с питанием нарушений статуса микроэлементов в условиях ЖДА указывает на необходимость разработки и реализации соответствующих интервенционных стратегий для предотвращения дефицита микроэлементов и борьбы с ним — добавки, обогащения и диверсификации/модификации рациона.
Это исследование было выполнено при финансовой поддержке Медицинского университета, г. Плевен, Болгария, и Сумского государственного университета, Украина.
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
1. Ranganathan PN, Lu Y, Jiang L, Kim C, Collins JF. Экспрессия и активность белка сывороточного церулоплазмина увеличиваются у крыс с дефицитом железа и дополнительно усиливаются при более высоком потреблении меди с пищей. Кровь . 2011;118(11):3146–3153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Bárány E, Bergdahl IA, Bratteby L-E, et al. Статус железа влияет на уровни микроэлементов в крови и сыворотке человека. Экологические исследования . 2005;98(2):215–223. [PubMed] [Академия Google]
3. Чой Дж.В., Ким С.К. Взаимосвязь уровней свинца, меди, цинка и кадмия с параметрами кроветворения и железа у здоровых подростков. Анналы клинических и лабораторных наук . 2005;35(4):428–434. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
4. Watts DL. Пищевые отношения железа. Журнал ортомолекулярной медицины . 1988;3(3):110–116. [Google Scholar]
5. Всемирная организация здравоохранения. Женева, Швейцария: Всемирная организация здравоохранения; 2001. Критерии гигиены окружающей среды 221: Цинк. [Академия Google]
6. Всемирная организация здравоохранения. Женева, Швейцария: Всемирная организация здравоохранения; 1998. Критерии гигиены окружающей среды 200: Медь. [Google Scholar]
7. Оливарес М., Хертрампф Э., Уауи Р. Взаимодействие меди и цинка при анемии: взгляд общественного здравоохранения. В: Kraemer K, Zimmermann MB, редакторы. Пищевая анемия . Базель, Швейцария: Sight and Life Press; 2007. С. 99–109. [Google Scholar]
8. Ваджуннеса М., Бегум Н., Фердоуси С., Ахтер С., Куариши С.Б. Цинк и медь в сыворотке у подростков с дефицитом железа. Журнал Общества физиологов Бангладеш . 2009;4(2):77–80. [Google Scholar]
9. Gürgöze MK, Ölcücü A, Aygün AD, Taskin E, Kilic M. Уровни цинка, селена, железа и меди в сыворотке и волосах у детей с железодефицитной анемией. Исследование биологических микроэлементов . 2006;111(1–3):23–29. [PubMed] [Google Scholar]
Gürgöze MK, Ölcücü A, Aygün AD, Taskin E, Kilic M. Уровни цинка, селена, железа и меди в сыворотке и волосах у детей с железодефицитной анемией. Исследование биологических микроэлементов . 2006;111(1–3):23–29. [PubMed] [Google Scholar]
10. Эдже А., Уяник Б.С., Ишкан А., Эртан П., Йигитоглу М.Р. Повышенный уровень меди в сыворотке крови и сниженный уровень цинка в сыворотке крови у детей с железодефицитной анемией. Исследование биологических микроэлементов . 1997;59(1–3):31–39. [PubMed] [Google Scholar]
11. Cole CR, Grant FK, Swaby-Ellis ED, et al. Дефицит цинка и железа и их взаимосвязь у малообеспеченных афроамериканских и латиноамериканских детей в Атланте. Американский журнал клинического питания . 2010;91(4):1027–1034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Turgut S, Polat A, Inan M, et al. Взаимодействие между анемией и уровнями железа, цинка, меди, кадмия и свинца в крови у детей. Индийский журнал педиатрии . 2007;74(9):827–830. [PubMed] [Google Scholar]
2007;74(9):827–830. [PubMed] [Google Scholar]
13. Тургут С., Хачиоглу С., Эммунгил Г., Тургут Г., Кескин А. Связь между железодефицитной анемией и уровнями меди, цинка, кадмия и свинца в сыворотке. Польский журнал экологических исследований . 2009;18(2):273–277. [Google Scholar]
14. Хегази А.А., Захер М.М., Абд Эль-Хафез М.А., Морси А.А., Салех Р.А. Связь между анемией и уровнями свинца, меди, цинка и железа в крови у детей. Исследовательские заметки BMC . 2010;3, статья 133 [бесплатная статья PMC] [PubMed] [Google Scholar]
15. Де ла Крус-Гонгора В., Гаона Б., Виллалпандо С., Шамах-Леви Т., Робледо Р. Анемия и железо, цинк, медь дефицит магния у мексиканских подростков: Национальное исследование здоровья и питания, 2006 г. Salud Publica Mex . 2012;54(2):135–145. [PubMed] [Google Scholar]
16. Gropper SS, Bader-Crowe DM, McAnulty LS, White BD, Keith RE. Истощение железа без анемии, прием пероральных добавок железа и показатели статуса меди у женщин студенческого возраста. Журнал Американского колледжа питания . 2002;21(6):545–552. [PubMed] [Google Scholar]
Журнал Американского колледжа питания . 2002;21(6):545–552. [PubMed] [Google Scholar]
17. Shah F, Kazi TG, Afridi HI, et al. Оценка статуса микроэлементов и токсичных металлов в биологических образцах (волосы головы, кровь и моча) нормальных и анемичных детей двух возрастных групп. Исследование биологических микроэлементов . 2011;141(1–3):131–149. [PubMed] [Google Scholar]
18. Кнович М.А., Ильясова Д., Иванова А., Молнар И. Связь между медью в сыворотке и анемией у взрослого населения Второго национального обследования здоровья и питания (NHANES II). Британский журнал питания . 2008;99(6):1226–1229. [PubMed] [Google Scholar]
19. Ани М., Моштаги А.А. Влияние хрома на параметры, связанные с метаболизмом железа. Исследование биологических микроэлементов . 1992; 32: 57–64. [PubMed] [Google Scholar]
20. Лукаски Х.К., Болончук В.В., Сидерс В.А., Милн Д.Б. Добавки хрома и тренировки с отягощениями: влияние на состав тела, силу и статус микроэлементов у мужчин.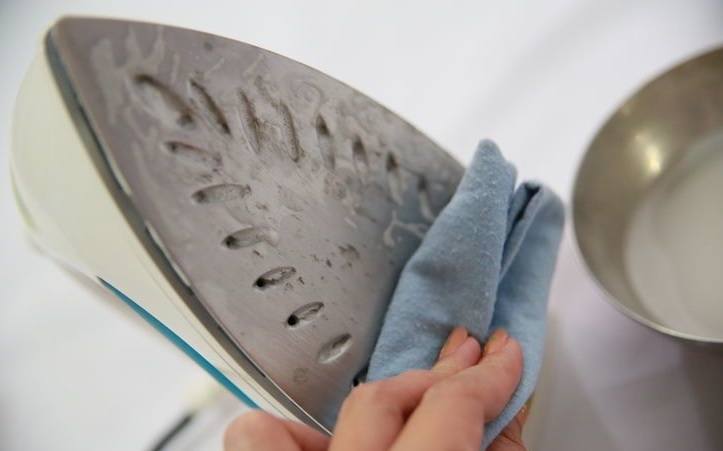 Американский журнал клинического питания . 1996;63(6):954–965. [PubMed] [Google Scholar]
Американский журнал клинического питания . 1996;63(6):954–965. [PubMed] [Google Scholar]
21. Максвелл П., Сальников К. HIF-1: фактор транскрипции, чувствительный к кислороду и металлам. Биология и терапия рака . 2004;3(1):29–35. [PubMed] [Google Scholar]
22. Всемирная организация здравоохранения. Железодефицитная анемия: оценка, профилактика и контроль — руководство для руководителей программ . Женева, Швейцария: Всемирная организация здравоохранения; 2001. [Google Scholar]
23. Stookey LL. Феррозин — новый спектрофотометрический реактив на железо. Аналитическая химия . 1970;42(7):779–781. [Google Scholar]
24. Soomro R, Ahmed MJ, Memon N. Простое и быстрое спектрофотометрическое определение следовых количеств хрома с использованием бис (салицилового альдегида) ортофенилендиамина в неионогенной мицеллярной среде. Турецкий химический журнал . 2011;35(1):155–170. [Google Scholar]
25. Сандерман Ф. В. мл., Марзук А., Крисостомо М.С., Уэтерби Д.Р. Электротермическая атомно-абсорбционная спектрофотометрия никеля в гомогенатах тканей. Анналы клинических и лабораторных наук . 1985;15(4):299–307. [PubMed] [Google Scholar]
В. мл., Марзук А., Крисостомо М.С., Уэтерби Д.Р. Электротермическая атомно-абсорбционная спектрофотометрия никеля в гомогенатах тканей. Анналы клинических и лабораторных наук . 1985;15(4):299–307. [PubMed] [Google Scholar]
26. Бжозовска Б., Завадска Т. Метод атомно-абсорбционной спектрофотометрии для определения свинца, кадмия, цинка и меди в различных растительных продуктах. Roczniki Panstwowego Zakladu Higieny . 1981;32(1):9–15. [PubMed] [Google Scholar]
27. Бругнара К. Референтные ценности в младенчестве и детстве. В: Оркин С.Х., Натан Д.Г., редакторы. Гематология младенчества и детства Натана и Оски . 7-е издание. Эльзевир Сондерс; 2009. с. п. 1774. [Google Scholar]
28. Glader B. Анемии. В: Клигман Р.М., Берман Р.Э., Дженсон Х.Б., Стэнтон Б.Ф., редакторы. Учебник педиатрии Нельсона . 18 выпуск. Филадельфия, Пенсильвания, США: Эльзевир Сондерс; 2007. с. п. 2003. [Google Scholar]
29. Эндрюс Н.К., Ульрих К. К., Флеминг М.Д. Нарушения обмена железа и сидеробластная анемия. В: Оркин С.Х., Натан Д.Г., редакторы. Гематология младенчества и детства Натана и Оски . 7-е издание. Эльзевир Сондерс; 2009. [Google Scholar]
К., Флеминг М.Д. Нарушения обмена железа и сидеробластная анемия. В: Оркин С.Х., Натан Д.Г., редакторы. Гематология младенчества и детства Натана и Оски . 7-е издание. Эльзевир Сондерс; 2009. [Google Scholar]
30. Hetet G, Devaux I, Soufir N, Grandchamp B, Beaumont C. Молекулярный анализ пациентов с гиперферритинемией и нормальным уровнем железа в сыворотке крови выявил мутации L-ферритина IRE и 3 новых мутаций ферропортина (slc11A3). Кровь . 2003; 102 (5): 1904–1910. [PubMed] [Google Scholar]
31. Акл М.А. Спектрофотометрическое и ААС определение следовых количеств цинка(II) в природных водах и крови человека после концентрирования фенантрахинонмонофенилтиосемикарбазоном. Аналитические науки . 2001;17(4):561–564. [PubMed] [Google Scholar]
32. Gibson RS. Принципы оценки питания . 2-е издание. Нью-Йорк, штат Нью-Йорк, США: Оксфордский университет; 2005. [Google Scholar]
33. Mason JB. Глава 237: витамины, микроэлементы и другие микроэлементы. В: Goldman L, Ausiello D, редакторы. Медицина Сесила . 23-й выпуск. Филадельфия, Пенсильвания, США: Эльзевир Сондерс; 2007. [Google Scholar]
В: Goldman L, Ausiello D, редакторы. Медицина Сесила . 23-й выпуск. Филадельфия, Пенсильвания, США: Эльзевир Сондерс; 2007. [Google Scholar]
34. Leavelle DE, редактор. Справочник по толкованию медицинских лабораторий Мэйо: Интерпретационные данные для диагностических лабораторных тестов . Рочестер, штат Вирджиния, США: Лаборатории; 2001. [Google Scholar]
35. Всемирная организация здравоохранения. Женева, Швейцария: Всемирная организация здравоохранения; 1991. Критерии гигиены окружающей среды 108: никель. [Google Scholar]
36. Stoltzfus RJ, Mullany L, Black RE. Железодефицитная анемия. В: Эззати М., Лопес А.Д., Роджерс А., Мюррей К.Дж.Л., редакторы. Сравнительная количественная оценка рисков для здоровья. Отношение глобального и регионального бремени болезней к отдельным основным факторам риска . Женева, Швейцария: Всемирная организация здравоохранения; 2004. стр. 164–165. [Google Scholar]
37. Voskaki I, Arvanitidou V, Athanasopoulou H, Tzagkaraki A, Tripsianis G, Giannoulia-Karantana A. Уровни меди и цинка в сыворотке здоровых греческих детей и их родителей. Исследование биологических микроэлементов . 2010;134(2):136–145. [PubMed] [Google Scholar]
Уровни меди и цинка в сыворотке здоровых греческих детей и их родителей. Исследование биологических микроэлементов . 2010;134(2):136–145. [PubMed] [Google Scholar]
38. Международная консультативная группа по цинковому питанию (IZiNCG), Brown KH, Rivera JA, et al. Технический документ № 1 Международной консультативной группы по цинковому питанию (IZiNCG). Оценка риска дефицита цинка в популяциях и варианты борьбы с ним. Бюллетень о пищевых продуктах и питании . 2004;25(1, приложение 2):S99–S203. [PubMed] [Google Scholar]
39. Kaji M, Nishi Y. Рост и минералы: цинк. Рост, генетика и гормоны (GGH) 2006;22(1):1–10. [Google Scholar]
40. Тейлор А., Редворт Э.В., Морган Дж.Б. Влияние диеты на статус железа, меди и цинка у детей в возрасте до 24 месяцев. Исследование биологических микроэлементов . 2004;97(3):197–214. [PubMed] [Google Scholar]
41. Gibson RS, Abebe Y, Stabler S, et al. Цинк, беременность, инфекция и железо, но не статус витамина B-12 или фолиевой кислоты, определяют уровень гемоглобина во время беременности в Южной Эфиопии. Журнал питания . 2008;138(3):581–586. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Журнал питания . 2008;138(3):581–586. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Оливарес М., Уауи Р. Медь как необходимое питательное вещество. Американский журнал клинического питания . 1996;63(5):791С–796С. [PubMed] [Google Scholar]
43. Hayton BA, Broome HE, Lilenbaum RC. Анемия, вызванная дефицитом меди, и нейтропения, вторичная по отношению к кишечной мальабсорбции. Американский журнал гематологии . 1995;48(1):45–47. [PubMed] [Академия Google]
44. Кузены Р.Дж., МакМахон Р.Дж. Интегративные аспекты переносчиков цинка. Журнал питания . 2000;130(5):1384S–1387S. [PubMed] [Google Scholar]
45. Глухчева Ю., Атанасов В., Иванова Ю., Митева М. Кобальт-индуцированные изменения в селезенке мышей на разных стадиях развития. Журнал токсикологии и гигиены окружающей среды A . 2012;75(22-23):1418–1422. [PubMed] [Google Scholar]
46. Anke M, Groppel B, Kronemann H, Grün M. Никель — необходимый элемент. Научные публикации МАИР . 1984; (53): 339–365. [PubMed] [Google Scholar]
Научные публикации МАИР . 1984; (53): 339–365. [PubMed] [Google Scholar]
47. Muñoz M, Villar I, García-Erce JA. Обновление физиологии железа. Всемирный журнал гастроэнтерологии . 2009;15(37):4617–4626. [PMC free article] [PubMed] [Google Scholar]
48. Glader B. Анемии неадекватной продукции. В: Клигман Р.М., Берман Р.Э., Дженсон Х.Б., Стэнтон Б.Ф., редакторы. Учебник педиатрии Нельсона . 18 выпуск. Филадельфия, Пенсильвания, США: Эльзевир Сондерс; 2007. с. п. 2013. [Google Академия]
49. Потребность человека в витаминах и минералах . Рим, Италия: Отдел пищевых продуктов и питания ФАО; 2001. Консультация экспертов ФАО/ВОЗ по потребностям человека в витаминах и минералах. [Google Scholar]
50. Шарма А.Д. Диета с низким содержанием никеля в дерматологии. Индийский журнал дерматологии . 2013;58(3):240–247. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Микроэлементы — Знание @ AMBOSS
Последнее обновление: 9 сентября 2022 г.
Резюме
Основные микроэлементы — это пищевые элементы, включая железо, медь, цинк, йод, селен и серу, которые необходимы организму в минимальных количествах для нормального физиологического функционирования и развития. В то время как большинство незаменимых микроэлементов в первую очередь действуют как кофакторы для различных реакций, некоторые также функционируют как составляющие основных молекул (например, железо в гемоглобине и миоглобине), факторов транскрипции (например, цинковый палец) и аминокислот (например, сера в метионин и цистеин). Избыток и недостаток необходимых микроэлементов может вызывать симптомы и заболевания, наиболее важные из которых рассмотрены ниже.
Обзор
В биохимии микроэлементы — это пищевые элементы, которые необходимы организму в незначительных количествах для правильного функционирования и развития.
| Overview of the most important trace elements | ||||
|---|---|---|---|---|
| Trace element | Main function | Deficiency | Excess | |
| Iron |
|
|
| |
| Copper |
|
|
| |
| Zinc |
| |||
| Йод |
|
|
| |
| Селен |
|
|
| |
| Сера |
|
|
| |
Хром |
|
| ||
Фтор |
|
|
| |
Iron
General
- RDA: 10 мг/день (только 10% железа всасывается из кишечника)
- Пищевое железо
- Гемовое железо: из мяса
- Негемовое железо: из растений
- Двухвалентное железо (Fe 2+ ): в гемоглобине
- Трехвалентное железо (Fe 3+ ): в метгемоглобине
- Свободное железо: Fe 2+ может привести к образованию активных форм кислорода посредством реакции Фентона.

- H 2 O 2 + Fe 2+ → OH- + Fe 3+ + • OH (hydroxyl radical)
- Hydroxyl radicals → oxidative stress → DNA damage
- Поглощение железа
- Желудочная кислота приводит к снижению рН и способствует растворению железа в двенадцатиперстной кишке
- Всасывание происходит в двенадцатиперстной кишке и верхних отделах тощей кишки
- Фермент гепсидин регулирует всасывание железа в кишечнике.
- Гепсидин синтезируется в печени
- Его продукция регулируется белком гемохроматоза человека (белком HFE)
- Увеличение запасов железа в организме → ↑ белка HFE → ↑ гепсидина → предотвращение всасывания железа
- Дефицит железа → ↓ гепсидина → ↑ усвоение железа
- Трехвалентное железо (негемовое железо, Fe 3+ ) в основном восстанавливается до двухвалентного железа (Fe 2+ ), а затем абсорбируется.

- Витамин С увеличивает абсорбцию (превращает Fe 3+ в Fe 2+ ).
- Кальций снижает всасывание (из-за хелатирования железа).
- Меньшая часть железа поглощается в виде трехвалентного железа (Fe 3+ ).
- Гемовое железо может непосредственно всасываться клетками кишечника.
- Железный транспорт
- Ферропортин (ингибируемый гепсидином) транспортирует двухвалентное железо (Fe 2+ ) из энтероцитов в кровоток. [2]
- Фермент ферроксидаза (также известный как церулоплазмин) окисляет двухвалентное железо обратно в трехвалентное (превращает Fe 2+ → Fe 3+ ).
- Трансферрин: связывает и транспортирует трехвалентное железо (Fe 3+ ) к клеткам-предшественникам эритроидного ряда (в костном мозге) для синтеза гемоглобина.
Хранение, переработка и потери железа
[3] [4]- Накопление железа
- Общее содержание железа в организме: ∼ 3 г (♀)/∼ 6 г (♂).
 [5]
[5] - Железо присутствует в организме в двух формах:
- Функциональное железо (80%): гемоглобин (наибольшая доля), миоглобин, ферменты цитохрома
- Хранение железа (20%): как Fe 3+ ; [6]
- Ферритин: гепатоциты, макрофаги, энтероциты
- Гемосидерин: гепатоциты
- Общее содержание железа в организме: ∼ 3 г (♀)/∼ 6 г (♂).
- Переработка железа
- Ретикулоэндотелиальные макрофаги (в селезенке и печени) фагоцитируют стареющие эритроциты и высвобождают железо из гемоглобина.
- Трансферрин связывает высвободившееся железо и транспортирует его в костный мозг для эритропоэза.
- Потеря железа
- Потеря эпителиальных клеток кожи и слизистых оболочек → ежедневная потеря 1–2 мг железа
- Любой источник кровотечения (например, менструация, скрытое желудочно-кишечное кровотечение) увеличивает потерю железа.

Функция
- Интегральный компонент гемоглобина и миоглобина
- Кофактор для:
- Цитохром С, цитохром Р450
- Пероксидазы
- Металлопротеазы (например, НАДН-дегидрогеназа)
- Фосфоенолпируваткарбоксикиназа (глюконеогенез), аконитаза (цикл Кребса)
- Рибонуклеотидредуктаза (синтез ДНК и РНК)
Дефицит
Подробнее о клинических особенностях, диагностике и этиологии дефицита железа см. в статье о железодефицитной анемии.
- Причины
- Снижение потребления
- Снижение поглощения
- Повышенный спрос (например, лактация, скачок роста, беременность)
- Потеря железа (например, меноррагия, желудочно-кишечное кровотечение)
- Клинические признаки: утомляемость, вялость, бледность.
Превышение
- Причины
- Гемохроматоз
- Токсичность железа (отравление)
Медь
Общие
- RDA: 900 мкг/день
- Источники: мясо, рыба, птица, овощи, зерновые, бобовые (например, чечевица, фасоль)
- Метаболизм
- Всасывается в желудке и тонком кишечнике
- Всасывается путем активного транспорта и пассивной диффузии
- Экспортируется из энтероцитов через АТФазу Р-типа Менкеса
- Связывает альбумин и транспортируется как часть энтерогепатической циркуляции
- Транспортируется церулоплазмином из печени в периферические ткани.

- Хранится в основном в печени и головном мозге. Небольшие количества хранятся в сердце, почках и поджелудочной железе.
- Всасывается в желудке и тонком кишечнике
Функция
- Кофактор для:
- Цитохром с-оксидаза (цепь переноса электронов)
- Тирозиназа (синтез меланина)
- Лизилоксидаза (важна для образования поперечных связей во время синтеза коллагена)
- Фактор V (каскад свертывания)
Дефицит
- Причины: в первую очередь из-за генетических мутаций, например, болезни Менкеса
- Из-за мутации АТФазы Менкеса Р-типа, белка, кодируемого геном ATP7A
- Вызывает неспособность транспортировать медь из энтероцитов в печень и другие клетки корпус → ↓ медные уровни
- Клинические признаки
- Депигментация кожи
- Аномальный рост волос
- Мышечная слабость
- Гепатоспленомегалия
- Отек
- Остеопороз
- Неврологические проявления: атаксия, невропатия
- Замедленное заживление ран
- Сидеробластная анемия
Избыток

Цинк
Общий
- RDA: 8-11 мг/день
- Источники: птица, устрицы, рыба, мясо, пищевые продукты, обогащенные цинком (например, злаки), орехи
- Метаболизм
- Всасывается преимущественно в двенадцатиперстной кишке и тощей кишке
- Всасывание регулируется металлотионеином
- Выводится в основном через желудочно-кишечный тракт
Функция
- Белковая структура
- Образует связи между цистеином и гистидином
- Образует факторы транскрипции цинковых пальцев
- Неотъемлемая часть многих ферментов (> 100), включая ДНК-полимеразу, карбоангидразу, АПФ, щелочную фосфатазу, металлотионеин, супероксиддисмутазу и коллагеназы.
Дефицит
- Причины
- Недостаточное питание
- Энтеропатический акродерматит: врожденный дефицит белка-транспортера, регулируемого цинком/железом (ZIP).

- Болезнь Крона, заболевания печени и почек
- Полное парентеральное питание (ППП)
- Хроническое заболевание печени (особенно цирроз печени)
- Клинические признаки
- Нарушение заживления ран
- Дисгевзия
- Аносмия
- Иммунная дисфункция
- Мужской гипогонадизм
- Дерматит
- Алопеция
- 8
- 5
У пациентов с циррозом печени: связано с ускоренным прогрессированием цирроза и усугублением клинических симптомов (например, печеночной энцефалопатии)
- Диарея
- Нарушение роста и развития
Превышение
- Причины: редко, но могут развиться из-за избыточного потребления цинка
- Клинические признаки
- Боль в животе
- Тошнота, рвота, диарея
Йод
Общий
- RDA: 150 мкг/день
- Источники: морепродукты, морские водоросли, растения, выращенные на богатой йодом почве, вода, овощи, йодированная поваренная соль
- Метаболизм
- Всасывается в тонком кишечнике
- Большая часть йодида поглощается и запасается щитовидной железой; излишки выводятся почками.

- Другое: Элементарный йод можно использовать в качестве дезинфицирующего средства.
Функция
- Неотъемлемая часть трийодтиронина (Т3) и тироксина (Т4)
- См. также «Гормоны щитовидной железы».
Дефицит йода
- Причины: снижение потребления (например, диета с низким содержанием йода)
- Клинические признаки: Дефицит йода проявляется признаками снижения синтеза гормонов щитовидной железы.
- Повышенная младенческая смертность
- Гипотиреоз
- Синдром врожденного дефицита йода
- Микседематозная кома
- Зоб
- Пациенты с нормальной функцией щитовидной железы обычно хорошо переносят избыток йода.

- Феномен Джода-Баседова
- Гипертиреоз вследствие избытка йода (например, после внутривенного введения контраста, вследствие приема амиодарона или других йодсодержащих препаратов и т. д.)
- Возникает вследствие активации всей щитовидной железы или очагов автономно функционирующей ткани щитовидной железы (например, узел щитовидной железы)
- Индуцированный у пациентов с ранее существовавшим гипотиреозом (например, эндемическим зобом, тиреоидитом Хашимото) и у пациентов с латентным или явным гипертиреозом
- Характеризуется симптомами гипертиреоза или тиреотоксикоза
- Эффект Вольфа-Чайкова [7] [8]
- Гипотиреоз вследствие избытка йода (эффект, противоположный феномену Йода-Баседова)
- Механизм временной ауторегуляторной компенсации для предотвращения гиперметаболического состояния в случае избытка йода
- Механизм: избыток йода ингибирует пероксидазу щитовидной железы → снижает выработку Т3/Т4.

Селен
Общий
- RDA: 55 мкг/день
- Источники: мясо, морепродукты, злаки и семена (например, бразильский орех)
- Метаболизм
- Присутствует в двух формах (у животных): селенометионин и селеноцистеин
- Всасывается в тонком кишечнике
- Хранится как селенометионин
- Активная форма: селеноцистеин
- Выводится с мочой
Функция
- Кофактор для ферментов, таких как глутатионпероксидаза; и йодтиронин дейодиназа 2 (выработка гормонов щитовидной железы)
Селен играет важную роль в нейтрализации оксидантного стресса в составе глутатионпероксидазы.
Дефицит
- Причины
- Недоедание
- Полное парентеральное питание
- Клинические признаки
- Кардиомиопатия
- Дисфункция скелетных мышц
- Дисфункция иммунной системы
- Макроцитоз
Избыток
- Причины: избыточное потребление селена (селеноз)
- Клинические признаки
- Тошнота, рвота, диарея
- Выпадение волос
- Изменения ногтей
- Усталость
- Периферическая невропатия
Сера
Общие
- Источники: мясо, яйца, орехи, лосось, листовые зеленые овощи (например, капуста, шпинат), бобовые
Функция
- Образует дисульфидные связи (между цистеиновыми остатками): неотъемлемая часть третичной структуры белков
- Присутствует в метионине, цистеине, гомоцистеине, цистине и таурине
- Присутствует в тиамине и биотине
- Присутствует в коферменте-А
- Содержится в кератине (помогает в поддержании состояния кожи, волос и ногтей)
- Необходим для синтеза коллагена
Дефицит
- Причины
- Дефицит встречается очень редко
- Диета на основе продуктов, выращенных на бедных серой почвах
- Диеты с низким содержанием белка
- Клинические признаки
- Артрит
- Ломкие ногти и волосы
- Тошнота, рвота, диарея
- Кожная сыпь
- Когнитивные нарушения (например, потеря памяти)
- Может способствовать ожирению, сердечным заболеваниям, болезни Альцгеймера
Превышение
- Причины: избыточное потребление продуктов, богатых серой
- Клинические признаки
- Тошнота, диарея, рвота
- Головная боль
Хром
Хром не считается незаменимым элементом, даже несмотря на то, что его часто ошибочно относят к таковым. Вопрос о том, может ли хром улучшить чувствительность к инсулину, остается спорным. [9]
Вопрос о том, может ли хром улучшить чувствительность к инсулину, остается спорным. [9]
Общий
- Источники: мясо (например, говядина), морепродукты, овощи (например, брокколи, стручковая фасоль, картофель), фрукты (например, яблоки, бананы), цельнозерновые продукты
Функция
- Компонент хромсодержащих факторов толерантности к глюкозе
- Может играть роль в чувствительности к инсулину (у людей с СД2 уровень хрома в крови ниже, чем у здоровых людей)
Дефицит
- Причины: полное парентеральное питание
- Клинические признаки: снижение чувствительности к инсулину и нарушение толерантности к глюкозе (из-за недостатка хрома в хромсодержащих факторах толерантности к глюкозе).
Превышение
- Причины: воздействие хрома во время, например, гальванизации (хромирования), производства красок и стекла
- Клинические признаки
- Острая токсичность: контактный дерматит, аллергическая астма, геморрагический гастроэнтерит
- Хроническая токсичность: рак легкого, изъязвление перегородки носа, легкое сварщика.

См. также «Токсичность хрома».
Фторид
Общий
[10]- Источники: фторированная вода, фторированная зубная паста, моллюски, чай (например, черный чай, зеленый чай),
Функция
[11]- Индукция остеогенеза за счет повышения активности остеобластов
- Ингибирование деминерализации зубной эмали
Дефицит
- Причины: снижение потребления
- Клинические признаки: кариес, остеопороз.
Превышение
- Причины
- Чрезмерное использование зубной пасты с фтором (вызывает только флюороз зубов)
- Чрезмерное потребление фтора, как правило, из-за очень высокого уровня в питьевой воде или добавках
- Клинические признаки: флюороз
- Флюороз зубов: пористая, пятнистая и непрозрачная эмаль с белым окрашиванием (из-за гипоминерализации при формировании постоянных зубов в течение первых 6 лет жизни)
- Скелетный флюороз (из-за минерализации связок, хрящей и периартикулярных мышц и деминерализации кости)
- Боль и скованность в суставах
- Деформации костей и суставов
Список литературы
- Поглощение железа.
 https://courses.washington.edu/conj/bess/iron/iron.htm .
Обновлено: 28 февраля 2017 г.
Доступ: 28 февраля 2017 г.
https://courses.washington.edu/conj/bess/iron/iron.htm .
Обновлено: 28 февраля 2017 г.
Доступ: 28 февраля 2017 г. - Дак К.А., Коннор мл. Поглощение и транспорт железа через физиологические барьеры. Биометаллы . 2016; 29 (4): стр. 573-591. doi: 10.1007/s10534-016-9952-2 . | Открыть в режиме чтения QxMD
- Кумар В., Аббас А.К., Астер Дж.К. Роббинс и Котран Патологическая основа заболевания . Эльзевир Сондерс ; 2014
- Soe-Lin S, Apte SS, Andriopoulos B Jr. Nramp1 способствует эффективной переработке макрофагами железа после эритрофагоцитоза in vivo. Proc Natl Acad Sci U S A . 2009 г.; 106 (14): стр. 5960-5965. doi: 10.1073/pnas.08106 . | Открыть в режиме чтения QxMD
- FINCH CA, HEGSTED M, KINNEY TD, et al. МЕТАБОЛИЗМ ЖЕЛЕЗА. Кровь . 1950 г.
 ; 5
(11): стр. 983-1008.
дои: 10.1182/кровь.v5.11.983.983 . | Открыть в режиме чтения QxMD
; 5
(11): стр. 983-1008.
дои: 10.1182/кровь.v5.11.983.983 . | Открыть в режиме чтения QxMD - Сайто Х. Метаболизм запасов железа. Нагоя J Med Sci . 2014; 76 (3-4): с.235-254.
- Люн А.М., Браверман Л.Е. Последствия избытка йода. Nat Rev Эндокринол . 2013; 10 (3): стр. 136-142. doi: 10.1038/nrendo.2013.251 . | Открыть в режиме чтения QxMD
- Марку К., Георгопулос Н., Кириазопулу В., Вагенакис А.Г. Йод-индуцированный гипотиреоз. Щитовидная железа . 2001 г.; 11 (5): стр. 501-510. дои: 10.1089/105072501300176462 . | Открыть в режиме чтения QxMD
- Винсент Дж.Б. Новые данные против хрома как важного микроэлемента. Журнал питания . 2017; 147 (12): стр. 2212-2219. doi: 10.3945/jn.117.255901. | Открыть в режиме чтения QxMD
- Кандути Д, Стербенк П, Артник и.
 Фтор: обзор использования и воздействия на здоровье. Материа Социо Медика . 2016; 28
(2): стр. 133.
doi: 10.5455/msm.2016.28.133-137. | Открыть в режиме чтения QxMD
Фтор: обзор использования и воздействия на здоровье. Материа Социо Медика . 2016; 28
(2): стр. 133.
doi: 10.5455/msm.2016.28.133-137. | Открыть в режиме чтения QxMD - Пундарик А.А., Боски А., Гундберг С., Вашишт Д. Биомолекулярная регуляция, состав и наноархитектура костного минерала. Научные отчеты . 2018; 8 (1). doi: 10.1038/s41598-018-19253-w . | Открыть в режиме чтения QxMD
Минералы: MedlinePlus
На этой странице
Основы
- Резюме
- Начните здесь
Узнать больше
- Связанные вопросы
- Особенности
Смотрите, играйте и учитесь
- Ссылки недоступны
Исследования
- Клинические испытания
- Журнальная статья
Ресурсы
- Справочная служба
- Найти эксперта
Для вас
- Дети
- Подростки
- Раздаточные материалы для пациентов
Минералы важны для вашего тела, чтобы оставаться здоровым.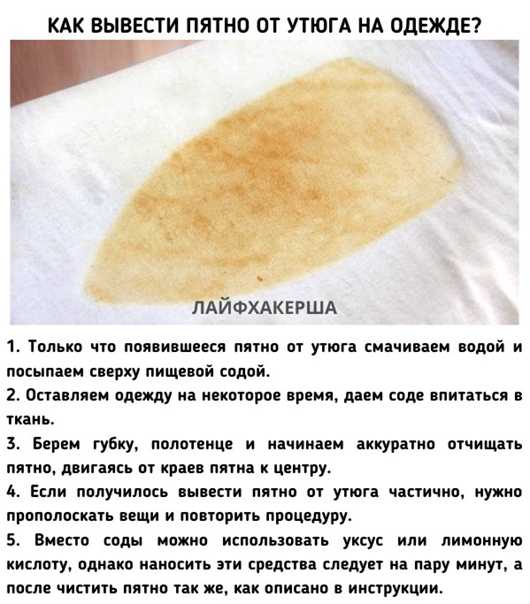 Ваше тело использует минералы для множества различных задач, в том числе для правильной работы костей, мышц, сердца и мозга. Минералы также важны для производства ферментов и гормонов.
Ваше тело использует минералы для множества различных задач, в том числе для правильной работы костей, мышц, сердца и мозга. Минералы также важны для производства ферментов и гормонов.
Существует два вида минералов: макроминералы и микроэлементы. Вам нужно большее количество макроминералов. К ним относятся кальций, фосфор, магний, натрий, калий, хлорид и сера. Вам нужно только небольшое количество микроэлементов. К ним относятся железо, марганец, медь, йод, цинк, кобальт, фторид и селен.
Большинство людей получают необходимое им количество минералов, употребляя в пищу разнообразные продукты. В некоторых случаях врач может порекомендовать минеральные добавки. Людям, которые имеют определенные проблемы со здоровьем или принимают некоторые лекарства, может потребоваться меньшее количество одного из минералов. Например, людям с хроническим заболеванием почек необходимо ограничить продукты с высоким содержанием калия.
- База данных этикеток пищевых добавок (DSLD) (Национальные институты здравоохранения, Управление пищевых добавок)
- Минералы: что они делают и где их получить (Техасский институт сердца) Также на Испанский
- Обзор минералов
(Мерк и Ко.
 , Инк.)
Также на Испанский
, Инк.)
Также на Испанский - Микроэлементы: что они делают и где их взять (Техасский институт сердца) Также на Испанский
- Витамины и минералы: как получить то, что вам нужно (Американская академия семейных врачей) Также на Испанский
- Металлы: в болезни и в здравии (Национальный институт общих медицинских наук)
- Хром (Национальные институты здравоохранения, Управление пищевых добавок) Также на Испанский
- Йод (Национальные институты здравоохранения, Управление пищевых добавок) Также на Испанский
- Магний (Национальные институты здравоохранения, Управление пищевых добавок) Также на Испанский
- Марганец (Национальные институты здравоохранения, Управление пищевых добавок) Также на Испанский
- Селен (Национальные институты здравоохранения, Управление пищевых добавок) Также на Испанский
- Цинк (Национальные институты здравоохранения, Управление пищевых добавок) Также на Испанский
- ClinicalTrials.
 gov: Минералы
(Национальные институты здоровья)
gov: Минералы
(Национальные институты здоровья)

 Вещь, с нанесенной на нее смесью, оставляется на солнце до полного высыхания.
Вещь, с нанесенной на нее смесью, оставляется на солнце до полного высыхания. Протрите место повреждения ватным тампоном, смоченным в уксусе, а затем прогладьте через влажную марлю.
Протрите место повреждения ватным тампоном, смоченным в уксусе, а затем прогладьте через влажную марлю.

 Для этого можно прополоскать ее.
Для этого можно прополоскать ее.






 [5]
[5] 






 https://courses.washington.edu/conj/bess/iron/iron.htm .
Обновлено: 28 февраля 2017 г.
Доступ: 28 февраля 2017 г.
https://courses.washington.edu/conj/bess/iron/iron.htm .
Обновлено: 28 февраля 2017 г.
Доступ: 28 февраля 2017 г. ; 5
(11): стр. 983-1008.
дои: 10.1182/кровь.v5.11.983.983 . | Открыть в режиме чтения QxMD
; 5
(11): стр. 983-1008.
дои: 10.1182/кровь.v5.11.983.983 . | Открыть в режиме чтения QxMD Фтор: обзор использования и воздействия на здоровье. Материа Социо Медика . 2016; 28
(2): стр. 133.
doi: 10.5455/msm.2016.28.133-137. | Открыть в режиме чтения QxMD
Фтор: обзор использования и воздействия на здоровье. Материа Социо Медика . 2016; 28
(2): стр. 133.
doi: 10.5455/msm.2016.28.133-137. | Открыть в режиме чтения QxMD , Инк.)
Также на Испанский
, Инк.)
Также на Испанский gov: Минералы
(Национальные институты здоровья)
gov: Минералы
(Национальные институты здоровья)
